

ニュース
2015年2月10日
再生医療製品の企業治験開始について
~自己の耳介軟骨から鼻の「インプラント型自己細胞再生軟骨」の実用化に向けて~
富士ソフト株式会社(本社:神奈川県横浜市/代表取締役 社長執行役員:坂下 智保)は、東京大学から技術移転を受け、実用化および製品化を目指し研究開発を行ってきました「インプラント型自己細胞再生軟骨」(以下、再生軟骨)について、企業治験を開始することをお知らせいたします。 |
|
|
この再生軟骨は、患者本人の耳介軟骨から採取した細胞を使って人工的に作る再生軟骨です。自己の耳介軟骨を1センチメートル角ほど採取し、血液の一部(血清)を使って軟骨細胞を50日間培養します。この細胞をアテロコラーゲンと混合して、縦5センチメートル、幅6ミリメートル、厚み3ミリメートル程度の大きさでドーム型に整形し、鼻に移植します。口唇口蓋裂などの先天的な疾患や病気や怪我により鼻に変形をきたしているため、鼻呼吸ができない、眼鏡が掛けられないといった患者の治療に使用します。 |
 |
現在行われている治療には、腸骨や頭蓋骨、肋軟骨の移植があります。しかし、ゲル状の細胞では高さは保てないこと、広範囲に骨や軟骨を採取した後の痛みや侵襲、これに付随する合併症、骨組織に由来する骨折や肋軟骨特有の曲がりが生じることなどの問題があります。そのため、鼻梁部分の軟骨形成には、立体的な形とある程度の硬さを併せ持った再生軟骨が必要でした。
当社は、産官学連携活動の一環として、2005年11月に、東京大学医学部附属病院で「軟骨・骨再生医療寄付講座」を開講しました。その後、2007年8月に軟骨と同じ位の硬さを持つ再生軟骨(インプラント型再生軟骨)の作製の成功と研究開発の成果が認められ、2007年10月に独立行政法人科学技術振興機構(以下、JST:Japan Science and Technology Agency)の企業向け公募プログラム「独創的シーズ展開事業 委託開発」の公募に採択※1されました。以後、東京大学から技術移転を受けて、東京大学医学部附属病院で実証された研究成果を元に、インプラント型再生軟骨の実用化及び製品化への研究に取り組んできました。実用化に向け課題となっていた、立体組織のまま細胞生存性と無菌状態を維持することに取り組み、再生軟骨の栄養交換効率を上げることにより容器を密閉した状態で長期間安定させることが可能な方法を開発しました。
また、本研究開発の経験を活かし、再生医療に最適なトレーサビリティーシステムを開発しました。二次元バーコードやRFIDタグによる検体管理を行うことで細胞の取り違えや検体紛失などを防止し、受け入れから提供に至るまでの情報を一元管理でき、作業内容はすべて自動的にシステムに記録されます。
当社は、この再生軟骨が既存治療に代わり、第一に選択される治療法になることを目指し、実用化及び製品化に取り組んでまいります。
■再生軟骨の実現に関わる要素技術について
(1) 軟骨細胞の大量培養技術
ヒト血清を用いた増殖培地の開発
⇒ 少量の軟骨組織から必要な細胞数(1億細胞以上)を確保できる
(2) 足場材料技術、足場材料に投与する技術
①ポリ乳酸(PLLA)多孔体による足場材料の開発(力学強度および生分解性を有する)
⇒ 三次元的形状と力学強度を実現
②細胞投与機の開発(細胞とアテロコラーゲンの懸濁および足場材料への均一な投与/
アイソレーター内に設置しており再生軟骨の無菌性を担保)
⇒ ロット内での均一な品質を保証
(3) 振とう培養技術
振とう培養技術の開発【特許出願中】 (培養2週間後の生存率、生細胞数が基準を満たすことを確認)
⇒ 製品安全性担保のために必要な無菌試験等出荷検査完了後の出荷が可能
⇒ 振とう培養による軟骨特性再獲得の促進が示唆
(4) 搬送技術
搬送技術の開発(72時間の搬送後も生存率、生細胞数が基準を満たすことを確認)
⇒ 製造元(当社)から全国の医療機関へ配送できる技術を確立(配送時間72時間)
■トレーサビリティーシステムについて
再生医療製品研究開発の経験を生かし、再生医療に最適なシステムを開発しました。材料(組織・血液等)を二次元バーコードやRFIDタグで管理することにより、受入から提供に至るまでの情報を一元管理できます。また、膨大な帳票作成作業をシステムで自動化・作業効率を向上することが可能です。なお、本システムは、再生医療等安全性確保法、GCTP省令※2にも準拠しています。
<主なメリット>
法令準拠の帳票出力/細胞取り違え防止/培養進捗状況管理/検体保管情報管理/材料管理(組織・血液等)
※1 採択された課題名について:
議題名:先天性顔面疾患に用いるインプラント型再生軟骨/研究者:東京大学 医学部付属病院 口腔外科 教授 高戸 毅
※2 GCTP省令について:医薬品医療機器等法における再生医療等製品の製造管理及び品質管理の基準に関する省令
■治験について
2015年1月6日付でインプラント型再生軟骨の治験計画届書を医薬品医療機器総合機構に提出しました。今後、東京大学医学部附属病院をはじめ3施設で治験を開始する予定です。2016年9月末の製造販売業取得を目標としております。
| 課題名 | インプラント型自己細胞再生軟骨の有効性・安全性を評価する臨床試験 |
| 目的 | インプラント型自己細胞再生軟骨を、鼻変形を有する口唇口蓋裂患者へ 適用することにより、その有効性および安全性について評価する。 |
| 対象患者(目標症例数) | 鼻変形を有する口唇口蓋裂患者(9症例) |
| 実施期間 | 2015年4月~2019年10月 (全例の6ヶ月後の評価終了後に承認申請予定) |
<治験スケジュールと今後の予定>
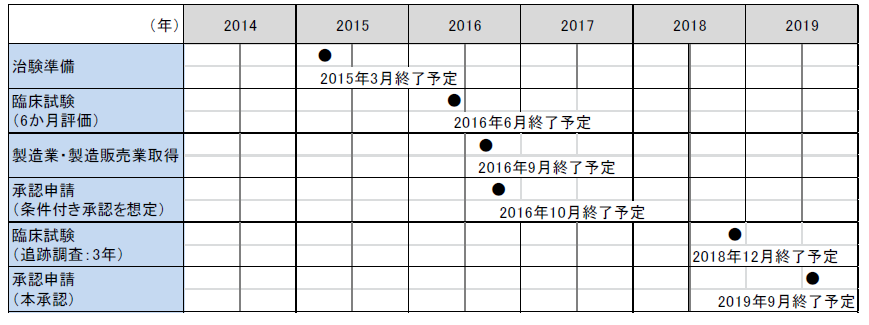
| |
以上
この件に関するお問い合わせ
■ニュースリリースについて |
|
![]()
- サイトのご利用について
- ソーシャルメディアガイドライン
- サイトマップ
- ©1994 FUJISOFT INCORPORATED


